
<abbr id="ex5dy"></abbr>
<sup id="ex5dy"></sup>
電話:
021-67610176傳真:

目前RNA,尤其是小RNA在整個基因研究領(lǐng)域都是研究熱點。但我們對RNA的認識足夠全面嗎?研究人員利用新的分析技術(shù)分析了市面上大多數(shù)抗腫瘤藥物與RNA的相互作用關(guān)系。結(jié)果顯示目前大多數(shù)藥物均存在潛在的非編碼RNA結(jié)合位點。該文章發(fā)表于近的《Cell Chemical Biology》。

抗腫瘤藥物存在潛在靶點:非編碼RNA
斯克里普斯研究所和加州生物醫(yī)學研究所(CALIBR)的科學家們通過研究發(fā)現(xiàn),某些類型的小分子藥物,包括市售的抗癌藥物,當中部分可能通過與疾病相關(guān)的非編碼RNA結(jié)合發(fā)揮作用。 他們的發(fā)現(xiàn)為開發(fā)小分子藥物開辟了新的研究途徑,這些藥物可以用來抵抗某些藥物無法治療的疾病,包括肌萎縮側(cè)索硬化癥(ALS),囊性纖維化,和某些類型的癌癥。
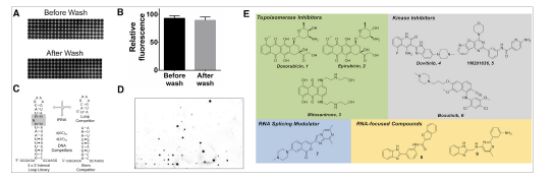
Scripps研究所化學教授Matthew D. Disney博士及其同事利用一種新型篩選技術(shù)來分析小分子藥物與數(shù)千個RNA基序的結(jié)合,發(fā)現(xiàn)了許多藥物類別,包括激酶和拓撲異構(gòu)酶抑制劑,它們可緊密結(jié)合特定的RNA,包括與癌癥有關(guān)的microRNA(miRNA)。
更詳細的研究表明,一種拓撲異構(gòu)酶抑制劑與致癌microRNA(miRNA)miR-21的有效結(jié)合足以逆轉(zhuǎn)體外侵襲性三陰性乳腺癌細胞系的進展。 在細胞化學生物學報告中,研究人員表示,他們的研究結(jié)果可以重新激活開發(fā)針對具有挑戰(zhàn)性的RNA靶標的小分子化合物的動力,并“為重新利用已知藥物奠定基礎(chǔ)”。正如他們所認為的,致癌非編碼RNA或許一直是既定的藥物目標。
RNA的潛在臨床應用
RNA在細胞生命過程中發(fā)揮著關(guān)鍵作用,RNA失調(diào)可能會導致疾病的發(fā)生。雖然1%至2%的基因組編碼蛋白質(zhì),但其中約80%轉(zhuǎn)錄為RNA。大多數(shù)開發(fā)RNA靶向療法的目的都集中在寡核苷酸的使用上,但盡管這些方法很有前景,但仍存在一些挑戰(zhàn),其中包括顯著的副作用。小分子可能是靶向RNA的更好選擇,但迄今為止,唯yi直接針對RNA的小分子藥物是抗菌藥物。
評估RNA的潛在可藥用性的一種方法是找出已知藥物是否與RNA結(jié)合并對關(guān)鍵細胞途徑產(chǎn)生影響。該團隊表示, “也許非編碼的人類RNA能夠在臨床環(huán)境中被批準用藥,但這些相互作用尚未被識別”。
為了進一步研究這一點,他們開發(fā)了一種基于小分子微陣列的方法,稱為AbsorbArray,它允許他們快速測試小分子化合物,包括FDA批準的和研究藥物,以結(jié)合數(shù)千種不同的RNA基序,并對抗文庫premessenger RNA。
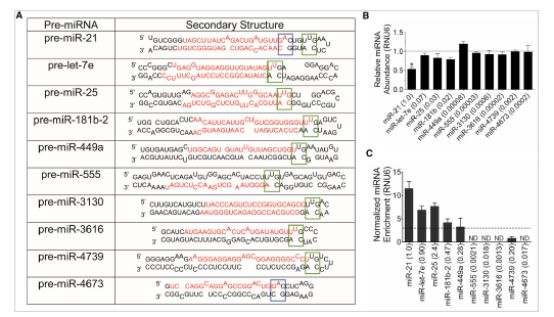
有趣的是,與先前研究的致癌miR-21結(jié)合的激酶抑制劑和拓撲異構(gòu)酶抑制劑已經(jīng)表明,miR-21可促進侵襲性癌癥表型及其前體,表明對pre-miR-21產(chǎn)生的生物也會發(fā)生影響。 “因此,已知通過靶向DNA影響細胞過程的這類化合物也可能通過影響miR-21的生物來引發(fā)抗癌作用,”
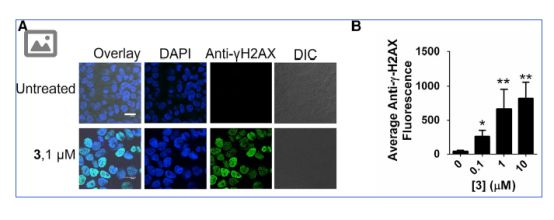
他們寫道。令人鼓舞的是,用拓撲異構(gòu)酶抑制劑3進行的試驗也表現(xiàn)出抑制miR-21和降低三陰性乳腺癌細胞系侵襲性的能力,即劑量依賴性。 “在這項研究中,發(fā)現(xiàn)了成熟miR-21的3種抑制水平,同時增加了pre-miR-21的水平,并且逆轉(zhuǎn)了由三陰性乳腺癌細胞中miR-21表達升高引起的侵襲性表型。他們表示,過度表達pre-miR21可以阻止小分子的作用。
研究成果或令研究人員更重視miRNA的臨床意義
作者表示,這項研究表明,各種藥物都具有結(jié)合RNA的能力,包括影響關(guān)鍵的非編碼致癌miRNA的拓撲異構(gòu)酶抑制劑。而研究人員也非常重視激酶抑制劑是“靶向RNA的關(guān)鍵化合物類”這一發(fā)現(xiàn)。
迪士尼博士評論說:“這些數(shù)據(jù)支持了這樣一種假設(shè),即看似非常普通的小分子藥物可以靶向RNA。作為一名化學家,我特別感興趣的是,現(xiàn)有的化合物如何在臨床上進行測試,并在一個蛋白質(zhì)靶標上進行優(yōu)化,在靶向RNA時也可能發(fā)現(xiàn)其新活性”。
參考文獻:
Sai Pradeep Velagapudi, Matthew G. Costales, Approved Anti-cancer Drugs Target Oncogenic Non-coding RNAs